
Experimentos técnicos simples são muito úteis para fazer com crianças, é passar um tempo juntos, instilar habilidades e entender por pequenos designers o básico de que os pães, como no famoso desenho animado, não crescem nas árvores.
Dessa vez, decidimos criar a fonte de corrente química mais simples e tentar aplicá-la a qualquer coisa prática. Falando sobre a aplicação prática, vale lembrar que apenas algumas gerações atrás, radioamadores, para fornecer seus receptores e amplificadores de rádio de bateria, foram oferecidos para fabricar vários tipos de células galvânicas ou baterias para produção independente. Estes são os elementos de Leklanshe e Popov [1], p. 9 ... 18, ou uma bateria de chumbo-potássio ou gás [1], p. 22 ... 28. Vários elementos de corrente relativamente alta foram conectados a uma bateria incandescente (filamento incandescente de tubos de rádio), dezenas de elementos menores, a uma bateria de ânodo, cuja voltagem poderia atingir 60-80 volts. As baterias estavam "molhadas" - com eletrólito líquido e exigiam cuidados e manutenção.
Então célula galvânica, algumas palavras "como?" e "por que?" Corrente elétrica ocorre quando os metais interagem. Nesse caso, ocorre uma diferença de potencial diferente (tensão). Em 1793, Alessandro Volta, construindo uma célula galvânica (pólo de Volta), estabeleceu a atividade relativa dos metais então conhecidos: Zn, Pb, Sn, Fe, Cu, Cu, Ag, Au. A "força" da célula galvânica acabou sendo a maior, mais distantes estavam os metais nessa linha (a série de tensões).

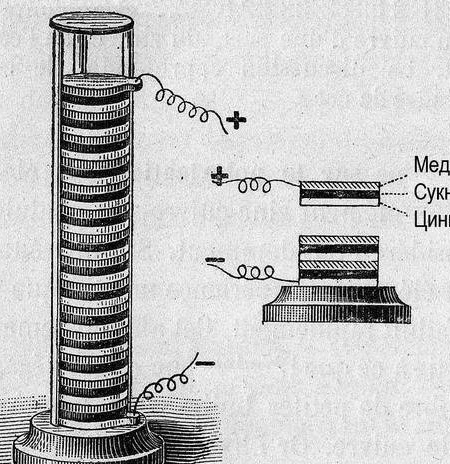
Posteriormente, para organizar os dados, o potencial do “eletrodo de hidrogênio” foi tomado como referência zero. Depois de medir o potencial dos metais emparelhados com ele, os metais experimentais foram organizados em uma fileira. A tabela resultante foi denominada "série eletroquímica de tensões metálicas" e, na sala de química, deve ficar ao lado do sistema periódico e do retrato de Dmitry Ivanovich.
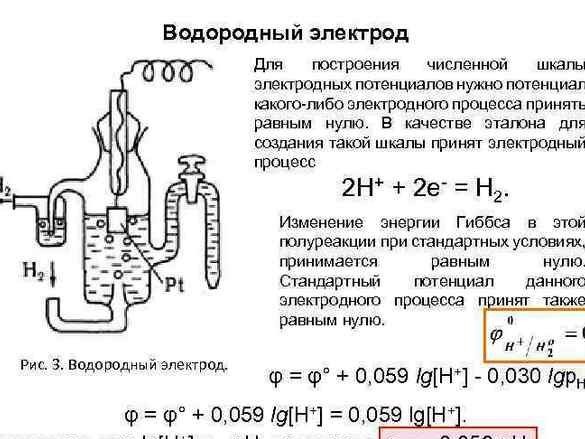

Várias tensões metálicas são uma engenhoca útil. No nosso caso, nós, como Alessandro Volta, saberemos - quanto mais os metais forem separados um do outro, maior será a tensão obtida.
Em nossos experimentos, como os clássicos, usamos cobre e zinco.Quando as placas são imersas no eletrólito, entre elas e a placa de zinco, ocorre uma reação química, como resultado da qual cargas negativas se acumulam na placa e são negativamente carregadas. Como resultado da reação que ocorre na célula galvânica, o eletrodo de zinco se dissolve gradualmente.
Em um eletrodo de cobre, durante a operação de uma célula galvânica, são formadas pequenas bolhas de hidrogênio que isolam a superfície do cobre do eletrólito. O fenômeno é chamado, em uma célula galvânica é prejudicial, eles estão lutando com ele. Para remover o hidrogênio liberado, substâncias chamadas hidrogênio são introduzidas no eletrólito. Em seu papel, muitas vezes são compostos de manganês, sulfato de cobre. Em experimentos simples, pode-se usar permanganato de potássio em farmácia.
O que usamos para o experimento.
Dispositivos e materiais.
Para a montagem de células galvânicas, como eletrodos de cobre, você pode usar fios, fios, folhas. O zinco pode ser extraído de elementos secos, produtos galvanizados podem ser usados. Em vez de zinco, você pode tentar usar um eletrodo de alumínio ou ferro. Cloreto de sódio para eletrólito, um pouco de fio macio de montagem. Você definitivamente precisa de um voltímetro ou multímetro, alicate, tesoura. Como recipientes, podem ser utilizados recipientes não metálicos de tamanho adequado. Vidro, mais conveniente que os copos de plástico leves - eles são mais pesados, mais estáveis, mais difíceis de derrubar. É muito bom se houver uma carga de baixa tensão e baixa corrente - um rádio simples, um relógio de quartzo etc.
Bateria "alta tensão" de fios e parafusos.
Fascinado pela simplicidade dos detalhes e pela tensão relativamente alta recebida, tentamos montar uma bateria dessas. Um par "clássico" de metais - cobre-zinco - é usado aqui. A idéia é usar fixadores galvanizados como eletrodo de zinco. Graciosamente. É claro que esse elemento não foi projetado para operação a longo prazo - uma fina camada de zinco se dissolve rapidamente, no entanto, isso não é importante para um experimento de curto prazo. Mas parafusos galvanizados ou engrenagens estão por toda parte cheios.
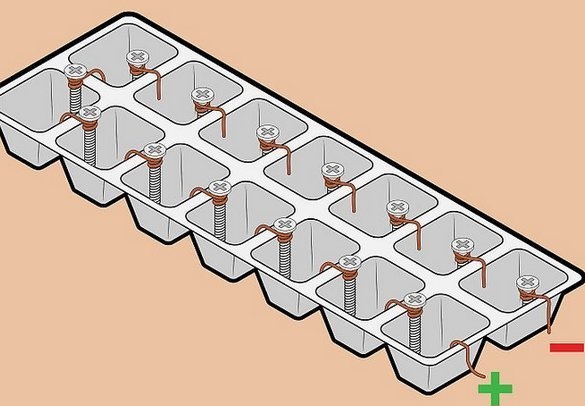
Um fio também é usado como eletrodo de cobre - também um material amplamente disponível - além disso, a instalação mais conveniente de elementos em uma bateria - todos os elementos são conectados em série - mais um ao menos do próximo. Nesse caso, a tensão é somada, a corrente permanece a mesma.
Vamos começar.
Depois de selecionar o número necessário de fixadores galvanizados do comprimento desejado, encontramos um fio de cobre adequado. Este é um fio de enrolamento em isolamento de verniz. O diâmetro do fio é de cerca de 0,5 mm.

Pólo limpa o isolamento do verniz várias vezes, com esforço para puxar o fio através de uma esmeril dobrada dupla de tamanho médio.


Em seguida, ele prepara um par de eletrodos - sob a cabeça de um parafuso autorroscante, envolve duas ou três voltas de fio e corta o excesso.

Montagem da bateria - uma calha foi usada como recipiente para congelar gelo. Você pode usar células de doces embalados, no entanto, eles são mais sutis. Depois de instalar os eletrodos nas paredes entre as células, enchemos os recipientes com eletrólito. Usamos uma solução de sal de mesa - uma colher de sopa com uma lâmina de 0,5 litros de água morna. Para encher, é muito conveniente usar uma seringa médica.


Encontramos mais alguns parafusos para os eletrodos e adicionamos elementos à bateria, foi o que obtivemos. A tensão em uma carga de alta impedância (resistência de entrada de um voltímetro digital) é considerável, mas em qualquer carga, por mais perceptível que seja, cai significativamente.
Tente fazer célula galvânica semelhante (bateria) com eletrodos maiores.
Como recipiente, usamos um frasco de meio litro (dois), placas de uma área considerável caberão nele. Como eletrodos, pegamos uma fina folha de cobre e zinco - os restos de um vidro de um elemento "seco" da fábrica, desmontado durante a produção de grafite para revestimento refratário.

Limpamos os restos de sais cristalinos secos com uma escova de arame e cortamos duas placas com aproximadamente uma tesoura com aproximadamente a mesma área. Em uma folha de cobre, corte duas listras iguais. Também com tesoura. Temos dois pares de eletrodos que equiparam nossos elementos, sem mais delongas, dobrando suas bordas no gargalo da lata.


Em um recipiente maior, preparamos um eletrólito - cloreto de sódio, dissolvido em água morna, a concentração é a mesma e os elementos preparados são derramados.


Conectamos os dois elementos em série, usando um pedaço do fio de montagem e dois clipes de crocodilo. Então, tudo bem, a tensão da bateria está próxima do "dedo" padrão, tente usar. Um elemento com uma tensão de 1,5 V é usado em um relógio eletromecânico. Além disso, o consumo atual do relógio é muito pequeno e nossa bateria poderá sobrecarregá-lo.

Removemos a bateria padrão do relógio e conectamos aos terminais um pedaço do fio de montagem. Observando a polaridade (placa de cobre - "+", zinco - "-"), conectamos nosso relógio a uma bateria improvisada, pronto! O relógio funciona, a tensão "afunda" para 1,3 V. O relógio funcionou perfeitamente por várias horas, até que todos nos vanglorássemos (por mais que seja um feiticeiro!).

Para a pista.
A constituição interna de qualquer criança é tal que a atenção em um assunto, ele é capaz de focar não mais de 15 ... 20 minutos, e todas as aulas com crianças devem ser planejadas para que elas se encaixem naquele momento ou alternem entre classes diferentes, caso contrário vocês serão atormentados.
Como carga, é melhor aplicar isso, seja ele móvel ou luminoso - os números no voltímetro impressionam a mente, mas não o coração. Além de relógios e calculadoras, certamente causará admiração o trabalho de uma bateria caseira de um pequeno receptor de rádio (como uma opção - uma caseira!).
Para uso a longo prazo, o eletrólito das células deve ser protegido contra poeira e evaporação e cuidar do despolarizador - bem, pelo menos entupir o frasco com um pedaço de filme plástico com uma faixa elástica e adicionar permanganato de potássio ao eletrólito. Além disso, é melhor coletar imediatamente o elemento mencionado de Popov.
Além dos parafusos auto-atarraxantes galvanizados, é possível usar chapa de aço galvanizada, para elementos grandes é mais conveniente - durante o experimento, você pode obter uma corrente e potência significativas (movendo os dedos no ar).
Lista de literatura usada.
1. Strelkov. Conheça e seja capaz. Engenheiro elétrico pioneiro. Detgiz. 1960 ano
2. V.S. Polosin, V.G. Prokopenko. Workshop sobre metodologia de ensino de química. Moscow, "Iluminismo", 1989, pp. 202,203.

